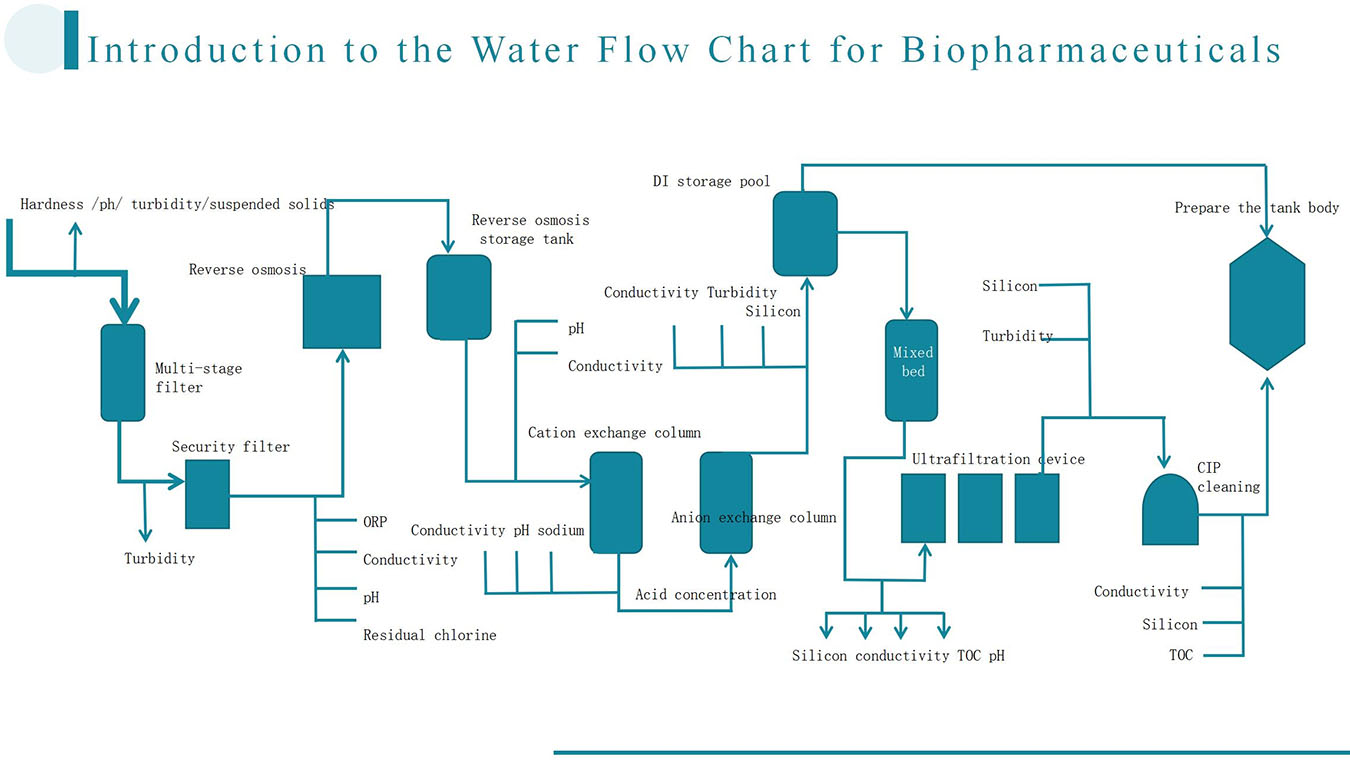
Was ist gelöster Sauerstoff?
Gelöster Sauerstoff (DO) bezieht sich auf molekularen Sauerstoff (O₂).₂) das in Wasser gelöst ist. Es unterscheidet sich von den Sauerstoffatomen, die in Wassermolekülen vorhanden sind (H₂Sauerstoff (DO) liegt im Wasser in Form einzelner Sauerstoffmoleküle vor, die entweder aus der Atmosphäre stammen oder durch Photosynthese von Wasserpflanzen gebildet werden. Die DO-Konzentration wird von verschiedenen Faktoren beeinflusst, darunter Temperatur, Salzgehalt, Wasserströmung und biologische Aktivitäten. Daher dient sie als wichtiger Indikator zur Beurteilung des Gesundheits- und Verschmutzungszustands aquatischer Ökosysteme.
Gelöster Sauerstoff spielt eine entscheidende Rolle für den mikrobiellen Stoffwechsel und beeinflusst Zellatmung, Wachstum und die Biosynthese von Stoffwechselprodukten. Höhere Konzentrationen an gelöstem Sauerstoff sind jedoch nicht immer vorteilhaft. Überschüssiger Sauerstoff kann zu einem verstärkten Abbau bereits vorhandener Produkte führen und potenziell toxische Reaktionen auslösen. Die optimalen Sauerstoffkonzentrationen variieren zwischen verschiedenen Bakterienarten. Beispielsweise wird die Sauerstoffkonzentration während der Penicillin-Biosynthese typischerweise bei etwa 30 % Luftsättigung gehalten. Sinkt die Sauerstoffkonzentration auf null und bleibt sie fünf Minuten lang auf diesem Niveau, kann die Produktbildung erheblich beeinträchtigt werden. Hält dieser Zustand 20 Minuten an, können irreversible Schäden auftreten.
Die gängigsten Sauerstoffsensoren können derzeit nur die relative Luftsättigung messen, nicht aber die absolute Konzentration an gelöstem Sauerstoff. Nach der Sterilisation des Kulturmediums wird so lange belüftet und gerührt, bis sich der Messwert stabilisiert hat. Dann wird der Wert auf 100 % Luftsättigung gesetzt. Alle weiteren Messungen während der Fermentation basieren auf diesem Referenzwert. Absolute Sauerstoffwerte lassen sich mit Standardsensoren nicht bestimmen und erfordern fortgeschrittenere Verfahren wie die Polarographie. Für die Überwachung und Steuerung von Fermentationsprozessen sind Messungen der Luftsättigung jedoch in der Regel ausreichend.
Innerhalb eines Fermenters können die Sauerstoffkonzentrationen (DO) regional stark variieren. Selbst bei stabilen Messwerten an einer Stelle können in bestimmten Kulturmedien Schwankungen auftreten. Größere Fermenter weisen tendenziell größere räumliche Variationen der Sauerstoffkonzentrationen auf, was das mikrobielle Wachstum und die Produktivität erheblich beeinträchtigen kann. Experimentelle Ergebnisse zeigen, dass die Fermentationsleistung unter schwankenden Bedingungen deutlich geringer ist als unter stabilen Bedingungen, obwohl die durchschnittliche Sauerstoffkonzentration bei 30 % liegen kann. Daher bleibt die Minimierung räumlicher Sauerstoffschwankungen bei der Vergrößerung von Fermentern – neben geometrischen und leistungstechnischen Aspekten – ein zentrales Forschungsziel.
Warum ist die Überwachung des gelösten Sauerstoffs bei der biopharmazeutischen Fermentation unerlässlich?
1. Zur Aufrechterhaltung optimaler Wachstumsbedingungen für Mikroorganismen oder Zellen
Industrielle Fermentation nutzt typischerweise aerobe Mikroorganismen wie Escherichia coli und Hefen oder Säugetierzellen wie CHO-Zellen (Chinese Hamster Ovary). Diese Zellen fungieren als „Arbeiterzellen“ im Fermentationssystem und benötigen Sauerstoff für Atmung und Stoffwechsel. Sauerstoff dient als terminaler Elektronenakzeptor in der aeroben Atmung und ermöglicht so die Energieproduktion in Form von ATP. Sauerstoffmangel kann zum Ersticken der Zellen, Wachstumsstillstand oder sogar zum Zelltod führen und letztendlich die Fermentation zum Scheitern bringen. Die Überwachung des Sauerstoffgehalts (DO-Gehalt) stellt sicher, dass die Sauerstoffkonzentrationen im optimalen Bereich für nachhaltiges Zellwachstum und die Lebensfähigkeit der Zellen bleiben.
2. Um eine effiziente Synthese der Zielprodukte zu gewährleisten
Ziel der biopharmazeutischen Fermentation ist nicht nur die Förderung der Zellproliferation, sondern auch die effiziente Synthese gewünschter Zielprodukte wie Insulin, monoklonaler Antikörper, Impfstoffe und Enzyme. Diese Biosynthesewege erfordern oft einen erheblichen Energieaufwand, der primär aus der aeroben Atmung stammt. Darüber hinaus sind viele an der Produktsynthese beteiligte Enzymsysteme direkt von Sauerstoff abhängig. Sauerstoffmangel kann diese Stoffwechselwege stören oder ihre Effizienz verringern.
Darüber hinaus fungiert der Sauerstoffgehalt als regulatorisches Signal. Sowohl zu hohe als auch zu niedrige Sauerstoffkonzentrationen können Folgendes bewirken:
- Veränderung zellulärer Stoffwechselwege, beispielsweise durch Umstellung von aerober Atmung auf weniger effiziente anaerobe Gärung.
- zelluläre Stressreaktionen auslösen, was zur Bildung unerwünschter Nebenprodukte führt.
- Einfluss auf die Expressionsniveaus exogener Proteine.
Durch die präzise Steuerung des Sauerstoffgehalts in verschiedenen Stadien der Fermentation ist es möglich, den Zellstoffwechsel auf eine maximale Synthese des Zielprodukts auszurichten und so eine Fermentation mit hoher Dichte und hoher Ausbeute zu erzielen.
3. Zur Vorbeugung von Sauerstoffmangel oder -überschuss
Sauerstoffmangel (Hypoxie) kann schwerwiegende Folgen haben:
- Zellwachstum und Produktsynthese kommen zum Erliegen.
Der Stoffwechsel verlagert sich auf anaerobe Wege, was zur Ansammlung von organischen Säuren wie Milchsäure und Essigsäure führt, welche den pH-Wert des Kulturmediums senken und die Zellen vergiften können.
- Länger anhaltende Hypoxie kann irreversible Schäden verursachen, und die Genesung ist selbst nach Wiederherstellung der Sauerstoffversorgung unvollständig.
Auch ein Sauerstoffüberschuss (Übersättigung) birgt Risiken:
- Es kann oxidativen Stress und die Bildung reaktiver Sauerstoffspezies (ROS) auslösen, welche Zellmembranen und Biomoleküle schädigen.
- Übermäßige Belüftung und Bewegung erhöhen den Energieverbrauch und die Betriebskosten, was zu unnötiger Ressourcenverschwendung führt.
4. Als kritischer Parameter für die Echtzeitüberwachung und die Regelung
Der gelöste Sauerstoff (DO) ist ein kontinuierlicher und umfassender Echtzeitparameter, der die internen Bedingungen des Fermentationssystems widerspiegelt. Änderungen des DO-Gehalts können verschiedene physiologische und betriebliche Zustände sensitiv anzeigen:
- Schnelles Zellwachstum erhöht den Sauerstoffverbrauch, wodurch der Sauerstoffgehalt sinkt.
- Substratmangel oder -hemmung verlangsamt den Stoffwechsel, verringert den Sauerstoffverbrauch und führt zu einem Anstieg des gelösten Sauerstoffs.
- Eine Kontamination durch fremde Mikroorganismen verändert das Sauerstoffverbrauchsmuster, was zu abnormalen Sauerstoffschwankungen führt und als Frühwarnsignal dient.
- Auch Gerätefehlfunktionen wie der Ausfall des Rührwerks, eine Verstopfung der Lüftungsrohre oder eine Verschmutzung der Filter können zu einem abnormalen Sauerstoffverhalten führen.
Durch die Integration der Echtzeit-DO-Überwachung in ein automatisiertes Feedback-Regelungssystem kann eine präzise Regelung der DO-Werte durch dynamische Anpassungen der folgenden Parameter erreicht werden:
Rührgeschwindigkeit: Eine höhere Rührgeschwindigkeit verbessert den Gas-Flüssigkeits-Kontakt durch das Aufbrechen von Blasen und erhöht somit die Sauerstoffübertragungseffizienz. Dies ist die gebräuchlichste und effektivste Methode.
- Belüftungsrate: Anpassung der Durchflussrate oder der Zusammensetzung des Einlassgases (z. B. Erhöhung des Luftanteils oder des Anteils an reinem Sauerstoff).
- Tankdruck: Durch die Druckerhöhung wird der Sauerstoffpartialdruck erhöht, wodurch die Löslichkeit gesteigert wird.
- Temperatur: Durch Senkung der Temperatur erhöht sich die Sauerstofflöslichkeit im Kulturmedium.
BOQUs Produktempfehlungen für die Online-Überwachung der biologischen Fermentation:
Veröffentlichungsdatum: 16. September 2025